Umblă vorba prin târg că fizica și matematica sunt niște materii grele, pentru care îți trebuie minte multă și specifică. Dezaprob hotărât această preconcepție. Nimic nu-i mai fain decât să înțelegi cum funcționează lumea.
De exemplu, radioactivitatea. Noroc că am eu astăzi chef de scris, că altfel probabil nu vă trezeați în ultima zi de vară cu asemenea nedumeriri.
Cea mai frumoasă idee din articolul de mai jos este că natura tinde mereu spre o stare de echilibru. În rest, vezi că ai un TL/DR la final, dacă n-ai chef de fizică azi, dar vrei să afli ceva nou.
1. ATOMUL
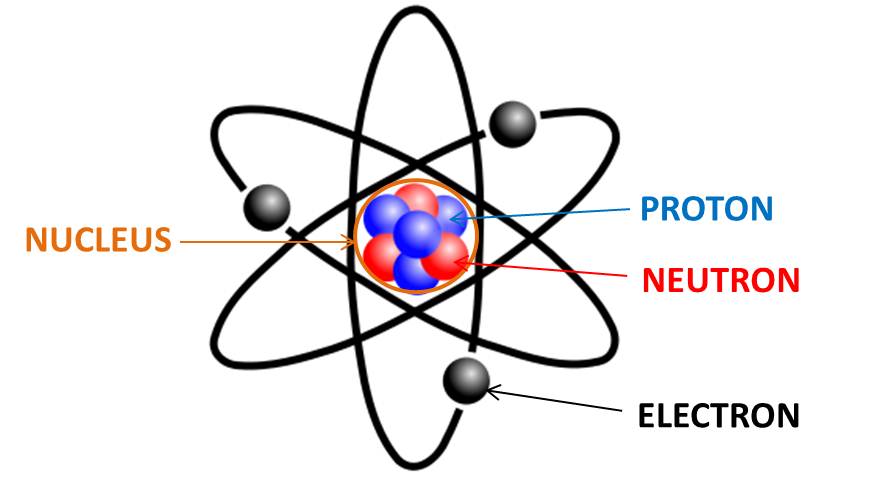
Totul începe de la atom: dacă proful vostru de fizică sau de chimie din generală avea măcar doi neuroni axați pe pedagogie, mai țineți minte că atomul este format din
- nucleu și
- învelișul de electroni.
Nucleul este greu și mic, învelișul de electroni este ușor și mare.
Chestie cool de spus la chefuri de tocilari: dacă nucleul ar avea 1 metru în diametru, învelișul de electroni ar avea 100km – cam asta e proporția.
ATOM = NUCLEU (+) + ÎNVELIȘ DE ELECTRONI (-)
Uite și o poză ciordită cu atomul – desigur nu la scară, pentru că vezi mai sus.
Buuun.
Dacă ar fi manelist, nucleul ar fi gras și ar avea valoare.
Asta pentru că este format din
- protoni (care au masă și sarcină pozitivă: PP înseamnă protoni pozitivi, nu pielea p*lii, ok?) și
- neutroni (care au masă, dar n-au valoare, adică sarcină).
La atomii de bun simț, numărul ne protoni e egal cu numărul de neutroni din nucleu, dar pe noi ne interesează ceilalți (vezi mai jos).
NUCLEU = PROTONI (+)+ NEUTRONI (0)
În jurul nucleului zboară electronii, care sunt negativi, că dacă ar fi pozitivi, s-ar întâmpla și în atom ceea ce se întâmplă când apropii doi poli de același semn ai unui magnet: protonii și electronii s-ar respinge, și atomul s-ar dezintegra. Electronii zboară pe orbite după anumite reguli și sunt ținuți în jurul nucleului de energii foarte mari.
Ne oprim să vă gândiți la o problemă: dacă un electron este mai departe de nucleu, are energie mai mare, sau mai mică față de unul care șade pe o orbită mai apropiată?
Pentru ca un atom să fie neutru, numărul de electroni (-) trebuie să fie egal cu numărul de protoni (+). Când numerele nu sunt egale, „pe mine mă cheamă Ion”.
ATOM STABIL: PROTONI (+) = ELECTRONI (-)
ION: PROTONI (+) <> ELECTRONI (-)
2. IZOTOPII
Ce ne interesează ca să înțelegem radioactivitatea naturală (că mai există și alte tipuri, dar nu-mi ajunge un articol pentru tot) sunt atomii care au luat-o razna: adică ăia care au mai mulți neutroni decât protoni. Ăștia se cheamă izotopi.
NUCLEU STABIL: PROTONI (+) =NEUTRONI (0)
IZOTOP: PROTONI (+) < NEUTRONI (0)
Doar unii izotopi sunt radioactivi. De ce?
Izotopii radioactivi sunt atomii care, pe lângă că nu sunt așezați într-ale nucleului, și au mai mulți neutroni decât protoni, mai sunt și nemulțumiți de starea lor: vor să se întoarcă la starea de echilibru (stabilitate). În nebunia lor, atomii ăștia au mai mult bun simț decât majoritatea dintre noi – vor să fie „cum trebă”.
Chestie cool de spus la chefuri de tocilari:Un nucleu instabil se mai cheamă și „excitat” (hă).
3. RADIOACTIVITATEA
Transformările pe care le fac izotopii pentru a ajunge la starea de echilibru se cheamă radioactivitate. Mai exact, izotopii radioactivi „pierd” particule (radiații alfa și beta) sau energie (radiații gamma). Felul de radiații emis de un izotop depinde de natura lui, deci n-are rost să ne omorâm neuronii cu „de ce”.
4. TIPURI DE RADIAȚII
Hai să le luăm pe rând:
Când un izotop emite particule, ghici ce particule pot fi? Of cors: protoni, neutroni sau electroni, că alte particule nu există (pentru scopul acestei lecții).
- Radiațiile alfa sunt emisii de 2 protoni + 2 neutroni.
- Radiațiile beta sunt emisii de electroni.
- Radiațiile gamma sunt emisii de fotoni (energie).
Radiațiile alfa sunt cele mai împuțite și toxice, pentru că sunt grele și foarte pozitive (doi protoni, get it?). Astea se lipesc de orice atom care are electroni, și îi fură 1-2 electroni, ca să devină stabile (după cum ziceam mai sus, totul în natură tinde spre starea de echilibru). Fenomenul se cheamă ionizare. Adică în urma radiației alfa rămân atomi de la care au fost ciordiți 1-2 electroni, deci le lipsesc niște sarcini negative. Adică ioni pozitivi. Închipuie-ți fenomenul în corpul uman….
Vestea bună e că radiații alfa se folosesc doar în laboratoare, nu zboară libere prin natură, și pentru că sunt mari, grele și puturoase, le poate opri și o foaie de hârtie. Vestea proastă e că intoxicația se face prin inhalare, dacă n-ai protecție.
Radiațiile beta sunt emisii de electroni. Aici treaba e mai grea: la materialele radioactive, inclusiv neutronii se pot dezintegra într-un proton și un electron. Protonul rămâne în nucleu, electronul bye-bye. Enter radiația beta. Mai rapide decât radiațiile alfa, deci intră mai adânc în materie (se numește penetrare, hă-hă), dar și cu putere de ionizare mai mică (logic: un amărât de electron n-o să se bată niciodată cu un 2 protoni+2 neutroni).
Radiațiile gamma sunt emisii de fotoni. ASL – PLS: Fotonii sunt particulele elementare ale tuturor undelor electromagnetice. Lumina e o undă electromagnetică. Radiațiile gamma sunt, de asemenea, unde electromagnetice. Un fel de lumină doar că nu.
Radiațiile gamma au viteză mare (comparativ cu alfa) și putere de penetrare în materiale. Sunt și ele ionizante, pentru că, în funcție de cât de puternice sunt, pot proiecta electronii atomilor afară de pe orbită. Dacă vă interesează cum, vă povestesc în comentarii.
Radiațiile X, adică alea care se folosesc în medicină, sunt tot radiații gamma electromagnetice , dar sunt generate artificial, într-un tub. Procedeul e foarte mișto și extrem de sigur. Și implică pocnirea unor electroni de o țintă, cam ca în reclama cu durex când se izbeau spermatozoizii de prezervativ.
5. CE SE ÎNTÂMPLĂ CU IZOTOPII DUPĂ CE EMIT RADIAȚII
Se întâmplă dezintegrare. Izotopii emit radiații și se dezintegrează până când devin un element stabil. Dacă ați auzit vreodată de perioada de înjumătățire, ea înseamnă chiar asta: timpul de care un material radioactiv are nevoie pentru a-și transforma jumătate din atomii inițiali în atomi stabili.
Când materialul a terminat de transformat toți atomii, se calmează și devine inactiv. Adică boring, pentru scopul acestui articol.
Chestie cool de spus la chefurile cu tocilari: Uraniul radioactiv (238) nu se dezintegrează în uraniu stabil, ci în Plumb (206).
Altă chestie cool de spus la chefurile cu tocilari: Un element radioactiv nu emite doar un tip de radiații, ci mai multe, după cum are natura chef (dar natura are chef după anumite reguli, pentru că e awesome).
TL/DR Radioactivitatea:
- Atomul: format din nucleu (+) și învelișul de electroni (-)
- Nucleul: format din protoni (+) și neutroni (neutri, doh!)
- Atom stabil: protoni = electroni; protoni = neutroni
- Izotop: protoni < neutroni
- Ion: protoni <> electroni
- Radioactivitate: izotopul vrea să devină stabil, deci emite particule (radiații alfa și beta) sau energie (radiații gamma)
- Radiații alfa: emisie de 2 protoni + 2 neutroni
- Radiații beta: emisie de electroni
- Radiații gamma: emisie de energie (fotoni)
- Dezintegrare radioactivă: procesul prin care un izotop radioactiv devine atom stabil și cuminte
- Perioada de înjumătățire: jumate din atomi se transformă.
No, așa-i că nu-i greu?
Editat: acest articol a avut inițial denumirea “Fizica pentru ITști”


NOU
cool 😛 eu am tinut minte din fizica de liceu doar caracteristicile fortei,
si asta pentru ca dirigul ni le cerea sa fie 3 si ramanea intr-un final un F U de toata frumusetea. forta are sens directie si modul 😛
NOU
Sigur PP înseamnă protoni pozitivi, nu pielea p*lii?
NOU
Păntru scopul acestui articol, da! Și dacă vreunul veți uita vreodată după asta că protonii-s pozitivi, eu îmi mănânc pălăria 🙂
NOU
Hehe, frumoasă lecție.
Povestea Chris Hadfield cum e să dormi în spațiu unde nu ești protejat de magnetosferă și-ți trec radiațiile fix prin creier de ai flashback-uri. Ca atunci când te resetează soacra cu tigaia.
NOU
io am mai spus că femeile .. e .. radioactive, uite că a apărut și demonstrațiunea
NOU
Și unele femei știe și de ce.
Pentru că vrem stabilitate 😉
NOU
imgur.com/RZWQWYx
NOU
Nea Ilie, am tras cu ochiul prin ciorne azi 😉
NOU
Bine, io-s mai neutron, așa, n-am valoarea ta.
Nu pot să mă uit în ciorne.
Dar e mai bine așa, că eu n-am timp 🙂
NOU
mă scuzați dar nu mai pot comenta pe aici astăzi, mă duc în bucătărie … pentru că așa vreau eu și doar pentru că, tot eu, vreau să spăl niște vase mai puțin … radioactive
NOU
Nea Ilie, zici că ești mai neutron? Asta, să știi, nu înseamnă mare lucru, am auzit eu că există și bomba cu neutroni !!!
NOU
Bomba cu neutroni era Marinela în clasa a 7a. Nu știi tu.
NOU
Mi-ar fi plăcut să fiu prezent la un curs predat de Rocket Ma’am :))
Dar nu înțeleg ce aveți cu Itștii. Ăia adevărații au terminat Poli, deci măcar primii 2 ani au mâncat fizică pe pâine. N-aș avea curajul să mă iau de fizica unui student la Calculatoare, UPB.
NOU
Idea articolului mi-a dat-o un ITst, care zicea că n-a putut băga la cap fizică și mate. Tu știi că eu n-am complexe din astea de superioritate..
LE: aici arhiblog.ro/sapa/#comment-1707471
NOU
Whaaa?? Ce ITist e ala? Nu știu cum o fi azi, dar, pe vremea mea, la Poli trebuia să dai examen de admitere (matematică și fizică). Ăia ca mine, mai prostani, își permiteau și note mai slabe pentru Electronica/Telecomunicații. Dar ca să fii admis la Calculatoare aveai nevoie de minimum 9,5. Mai greu dacă nu poți băga la cap fizică și mate.
LE: A, ok, citit. Ți-ai modificat (din nou) comentariul în timp ce-l scriam pe al meu 🙂
NOU
Mno, ia întreabă tu un ITst mai proaspăt care e diferența dintre big endian și little endian. Cei mai vechi mai știu și de rusul ăla cu tabelul lui cu tot.
NOU
@Andy Din fericire ITistii mai tineri au norocul sa nu mai programeze pe arhitecturi vechi și totul e în același endianness asa ca nu tre sa își puna probleme de byte ordering.
Din păcate pentru ITistul tânăr din mine, am ajuns într-o companie care încă mai depinde de servere Sun și IBM.
NOU
@tinky Karma 😀
NOU
Ce e aia byte ordering
NOU
Tipul din comentariu are vagi legaturi cu IT-ul din ce scrie. Update pagina web cred ca tine mai mult de o editare simpla de text. E greu de crezut ca poti sa faci niste programe ceva mai complicate si sa nu pricepi matematica mai ales ca partea de algoritmica e chiar putin mai abstracta decat matematica.
La politehnica la Calculatoare pe vremea mea se dadeau 2 examene de mate si unul de fizica dar erau 2-3 pe loc. Acum la Informatica la Cluj se da mate sau info la alegere dar sunt 7 pe loc. Astia de acum nu prea stiu ei multa fizica dar la partea de info ies unii mai buni acum din liceu decat ieseau inginerii de la calculatoare pe partea de programare.
NOU
@Maddame Păi, de fapt are legătură cu semantica. Cu linia aia fină dintre lumea obiectivă și cea subiectivă în care noi suntem conștienți și înțelegem ceva. Pe scurt, computerele funcționează cu 0 și 1, și în baza aceasta se construiește totul. Faptul că auziți de 8, 16 etc este pentru că sunt puteri ale lui 2 (0 și 1 adică două stări). Așa știu/pot ele procesoarele să funcționeze. Memoria unui procesor, a unui computer și cea de pe harduri etc este stocată la fel, în construcții în baza 2, grupate pe aceleași criterii. Acum, dacă vrei să scrii ceva peste 255 aceasta depășește 8 biți de memorie (octet, byte da?) și mai trebuie 8 biți. Deci, 256 înseamnă 255 + 1, poți pune 255 în byteul de jos (cu adresă mai mică) sau în byteul de sus (cu adresă mai mare). Informația de acolo, indiferent care este ea o interpretezi pe bază de convenție. Pe vremuri erau (nu știu dacă mai sunt) procesoare care interpretau în prima variantă ordinea aceasta a octeților/bytes iar altele care interpretau pe dos. Pentru procesoare este cumva mai la îndemână să citească un număr scris invers, și deci pe termen lung au ‘câștigat’. De aici ‘low endian’ și ‘big endian’ – de unde începi să citești zona de memorie dedicată unui număr pentru a-i interpreta valoarea.
NOU
Cum plm IT-ist care n-a putut baga la cap fizica, dar mai ales mate ? Eu am facut doar un amarat de liceu de informatica si tot mi-au crapat aia capul cu sase ore de mate si patru de fizica pe saptamana. Bine, nici eu n-am putut baga la cap, dar nici nu ma intitulez IT-ist. Am impresia, ca in ziua de azi, orice intinzator de fibra pentru RDS sau UPC se crede IT-ist.
NOU
cam 4-5 ore de fizica (cu profi plictisiti) sintetizate perfect in 10 min. de lectura placuta (bineinteles, sa ai o baza). mersi!
NOU
Off-topic: cand esti sapiosexual si urat esti constient din start ca alea bune-s luate.
NOU
It-istii ar trebui sa cunoasca destul de bine si fizica dar mai ales matematica. Cel putin cei care au o diploma in spate, nu cei ce au devenit IT-isti pentru ca citesc stackoverflow. Dar la ce oameni sunt acum prin IT, probabil ca prinde bine. E ca si cum ai face un curs de limba romana pentru jurnalisti, ca la ce talente se perinda si pe acolo, chiar nu e inutil.
NOU
Am scris mai sus de ce “pentru ITsti”.
DAR: pentru că nu vreau să discriminez, dacă 5 ITști cititori de Cetin îmi spun că știau ce am povestit mai sus, o să modific titlul în “fizica pentru mileniali”
LE: 10. Zece ITști. Am uitat cât de mulți cititori are Cetin 😉
NOU
@dorin, la ce foloseşte fizica în 90% din IT?
NOU
scuze @Maddame, nu am avut curiozitatea de a da click pe link-ul din comment-uri si a observa de la ce a pornit ideea postarii tale, recunosc ca titlul m-a facut sa simt ca IT-istii ar fi o specie cu intelegere limitata :D. Rar scriu impulsiv desi aici am simtit nevoia sa scriu, ar fi trebui sa las apa sa curga linistita si sa nu o mai tulbur.
Cred ca pentru cei care am trecut printr-o facultate de CS, Automatizari sau alte formate, matematica a fost o religie iar fizica a fost prezenta intr-o mare masura cel putin in primul an. Desigur mai nou in IT poti include o gramada de ramuri, si se pare ca IT-isti sunt si cei ce au avut un contact vag cu tehnologia.
@adyzah – stiu ca in mare parte IT se confunda cu SWD, dar sunt domenii si mai tehnice (ex automotive hardware) unde fizica ajuta macar cat sa nu arzi dispozitivele pe care lucrezi. De cata matematica are nevoie un frontend web developer ce nu lucreaza cu algoritmi sau AI?
NOU
@dorin, de unde şi acei 90%. Dar chiar şi aşa, în afară de electro-magnetism, de restul te poți lipsi: mecanică, optică, fluide, termodinamică.
NOU
Eu sunt un IT-ist care a dat bac-ul la astronomie (si da, am facut Poli, si un pic de Medicina). Mi-a placut fizica.
NOU
@madamme: sunt it-ist de stackoverflow, cum spunea cineva mai sus. Fără facultate.
Știam ce spuneai mai sus. Din chimia de liceu, chiar.
NOU
@Maddame sunt un it-ist care a terminat facultatea de fizica. Nu doar ca stiam, am si lucrat cu materiale radioactive 🙂
NOU
Poate mă lămureşte şi pe mine cineva. Ce e ăla un IT-ist ?
NOU
Apropo de atentia la detaliu inginereasca si dorinta de-a vedea cum functioneaza lucrurile, pentru mine ultima zi de vara e 22 septembrie. Anu’ asta in locul din Subcarpati unde stau eu echinocțiul pica pe 23, la 10:50.
PS: alta comparatie cu nucleul si atomii e o minge de fotbal pe Stade De France sau Alloanzarena.
NOU
Dacă ai sta în Brașov, ai ști empiric că odată cu Septembrie încep ploile și frigul, iar anotimpurile nu sunt știință, sunt o convenție, ca și calendarul.
Dacă nu mă crezi, mergi la ecuator sau în Australia.
NOU
Apropo, Echinocțiule: Comparația cu Stade de France e greșită rău. Fă tu raportul între diametrul unei mingi de fotbal (cam 20cm) și mărimea unui stadion (120x80m, parcă).
În primul rând, stadionul nu este sferic, să putem compara diametrele. În al doilea rând, raportul este maxim 1/600, FOARTE departe de 1/10.000. Nici dacă iei și tribunele nu te apropii.
Că tot vorbim de știință și numere…
NOU
Stadion, nu teren de fotbal. In ziua de azi stadioanele au forma cam de vanata/ zeppelin, deci e valabila comparatia.
NOU
Nu e. Stade de France are doar 35m înălțime. Și dacă i-ai lua dimensiunile maxime la vreo 200m lungime și 120m lățime (estimat), tot nu-ți dă. Nu mai insista în eroare, că nu-ți șade bine.
NOU
meh, daca tot vrem inginerie, vezi ca ultima zi de vara a fost undeva in jur de 6 7 august :P.
NOU
Scuze, a trebuit sa dau de mancare la animale.
Avem asa: masuri Allianz Arena (nu le-am mai gasit pe alea de la Paris, dar stiu ca iesea mai rotund calculul): 258 x 227 x 52, adica aprox 3 milioane de metri cubi.
Masuri minge: 6 litri, adica 0,006 metrii cubi.
Fa tu raportul dintre ele, si vezi daca iese.
NOU
Băh! Raportul ăla e 1 / 500 de milioane, bântui-v-ar Newton și Archimede visele!
Asta pe lângă faptul că elementele atomice nu se măsoară ca volum nici în coșmarurile lui Einstein!
NOU
Doamna, doamna, ziceți ceva și de s, p, d etc și zonele de probabilitate că sigur sunt câțiva care mai cred chestia cu planete dar mai mici.
NOU
Stai să cujet:
Electronii nu orbitează în jurul nucleului ca femeile în jurul lui Cristi Borcea.
Mai degrabă, ei „au voie” să stea numai la anumite distanțe de atom. Închipuiți-vă o minge care cade pe scări. Dacă nucleul pământului ar fi nucleul atomului, iar forța gravitațională, forța de atracție a nucleului atomic față de electroni, atunci ei ar avea voie să se așeze față de nucleu numai în punctele fixe reprezentate de treptele pe care cade mingea.
„Treptele” astea se cheamă orbite.
Un electron de pe o anumită orbită, are, desigur, o anumită energie. Ca să treacă pe o treaptă superioară (mai îndepărtată), el trebuie să primească energie. Dacă trece pe o treaptă inferioară (mai joasă pe modelul scării), el cedează energie. Aceste treceri se numesc salturi cuantice (quantum leaps), și cu asta puteți închide internetul pe ziua de azi.
NOU
sa spuna la lume ca poza cu atomul nu este corecta dpvd stiintific, sa povesteasca la lume de superpozitia cuantica?
NOU
Dar voi ce păziți, mă copii? Ce, aici suntem la școală, să fac eu, bietuleț, toată munca? Poate vreau și eu să mănânc niște cuante cu brânză rasă la cină, și voi – nimic….
Bântui-v-ar Bohr…
NOU
Asta e chimie, nu fizică, cel putin prima parte. Structura atomului se studiază în clasa a VII-a la chimie.
Ca it-ist, mi se pare ca ai simplificat prea mult gluma cu uraniu care se dezintegreaza in plumb. Pe drum mai avem si niste toriu, paladiu, radiu, radon, poloniu și bismut.
Nota: Web developperii sunt considerați ciuma it-iștilor, ne e rusine cu ei, dar ce sa facem, sunt de-ai noștri.
NOU
Corect și corect. La chimie am făcut prima oară, true…pe vremea noastră. Acum nu mai știu.
Numărul
13. AMR97 😉NOU
Wow, Rumbu, pot să te ating?
NOU
Si urmatorul articol: “Diferenta dintre fizica nucleara si chimie pe intelesul ITstului”
NOU
“Radiațiile X, adică alea care se folosesc în medicină, sunt tot radiații gamma”
Uhm, e fals. Radiațiile X și gama sunt fotoni (radiație electromagnetică) de lungime de undă (frecvență, energie) diferite, dar nu poți spune că radiațiile X sunt tot radiații gama. E ca și cum ai spune că un logan e un BMW. Nu e, dar ambele sunt autoturisme.
NOU
Ai dreptate. Am simplificat prea tare, încercând sa spun ca sunt unde electromagnetice,cam cum am făcut la fotoni și lumină.
Gamma au lungimi de unda similare (spectrul foarte mic), iar X au spectru foarte larg. De asta se vorbește de radiații moi și dure, și se filtrează cele nenecesare.
Nu m-am băgat in frecvente și lungimi de unda pentru ca trebuia sa încep cu teoria undelor, și deja lungeam prea tare pelteaua.
O sa modific in articol, totuși.
LE:ITst?
NOU
NOU
Scurt, concis şi la subiect. Bravo!
NOU
Dacă în liceu aveam o profa de fizica ca Maddame probabil altfel înțelegeam,, asa ca în afara de newton nu știu nimic,, aa și PP chiar la pielea pulii ma gândeam,, sau de vina radioactivitate de la zborul cu avionul de azi? Întreb pt un amic
NOU
Nu toate undele electromagnetice sunt și radioactive, poți zbura liniștit.
De asemenea, îți poți încălzi ciorba liniștit la microunde. Nu cauzează cancer.
NOU
de fapt, aia cu cancerul vine de la azbestul cu care erau izolate vechile cuptoare, gen anti radiatii:)))
NOU
Am auzit oameni altfel deștepți cum ziceau ca “microundele decapitează molecula, astfel încât rămâne molecula de zahăr, sa zicem, dar ca un om cu capul tăiat.”
I. Shit. You. Not.
Molecula cu capul taiat.
NOU
Am cam 10 zboruri pe luna,, la început când am început în Albania aveam la 2 zile.. Ma amuzam la faza cu înțelegerea fizicii de către noua generație, nici eu nu eram mai breaz,, mai ales chimia,, la fizica mai schiopatam doar pt ca era profa o bunaciune de 26 de ani,, și eram primu la șters tabla,, ca în rest nu am înțeles mare lucru. Azi ar trebui sa fie mai ușor cam orice materie, doar modalitatea sa fie interactiva și ușoara pt toti.
NOU
@Arhi:asta apropo de azbest. Acum 4 ani când mai dădeam cu sapa fizic în construcții,, și acum mai dau,, nu numai ma uit,,am demontat doua recipiente de apa din azbest, sa vezi ce ciudat se uitau la mine proprietarii,, fără mănuși, masca și alte chestii complicate, spart cu barosu, carat în camion și la depozitul pt materiale speciale. La ei veneau în combinezoane speciale, de zici ca erau radiații în zona, camion închis ermetic. Și pana atunci au băut timp de 40 de ani apa din acele recipiente și nu au pățit nimic.
NOU
@Maddame:cuptor cu microunde nu am folosit în viata mea,, nu mi-elene sa încălzesc o ciorba, deși ciorba mănâncă cam de3-4 ori pe an. Prostii despre microunde am auzit destule,de aceea evit sa ma bag în astfel de discutii, dacă ei știu mai bine cine sunt eu sa ii contrazic.
NOU
partea proasta e ca unii sunt chiar bine intentionati… cu 2 zile inainte de operatie i-am cerut imprumut un termometru, ca ma cam piscase o raceala, ea a venit cu un biblioraft de asul verde sau mai stiu eu ce brambureli cu coji de oua pisate fierte cu nu stiu ce bozii. bine, a venit si cu termometru, ba chiar si cu un paracetamol. da’ 2 zile a trebuit sa ascult tratate de medicina alternativa care m-ar fi facut bine in numai 6 luni, fara efort. nea doctoru’ ma rezolvat in 4 zile…
NOU
@Manu: azbestul nu e periculos cind e ud, fiindca nu pluteste in aer. Daca i-ai vazut pe baietii in combinezoane care demoleaza unde e azbest, ai vazut si cita apa folosesc ca sa-l ude (ca sa nu se faca praf). Fiindca praful de azbest odata inhalat nu se mai dezlipeste de pe alveolele pulmonare…
NOU
debci cum se bace bomba cu bneutron? nu buneti un blan, ceva?
NOU
Bunem, cum ză nu. Cât petrol abeți?
NOU
banelistig de multb. fara number. da ce Ahah bageti cu betrol duba ce are Ahmed bomba cu bneutroni?
NOU
Așteptăm cu nerăbdare partea despre colapsul funcției de undă. Pe aici a început totul să devină fucked up voodoo pentru mine. De ce are particula spin? Cum să te cheme Putnam? Și, cel mai important, cum poate o singură poziție să fie super?
NOU
Awww, vous voulez quantum mechanics avec moi!
*Blushes.
NOU
Simt entuziasmul prin monitor :))
Sunt diletant, ultima oară mi-am rupt gâtul în groapa de potențial când studențeam la Poli. Îmi amintesc cum au ieșit din Xerox vreo 100 de coli calde, toate despre groapă!
De curând, am vrut să fiu prietenos și i-am citit cartea unui coleg de editură: Noua paradigmă a gândirii – Lumi epistemologic diferite. Prin teoria LED (Lumi epis…) colegul încearcă să rezolve “teoria incompletă” din fizică. Mai greu să înțeleg abordarea filozofică dacă nu mi-e clară fizica din spate. Ergo, așteptăm un exhaustiv articol!
NOU
Hai ca aia cu spin-ul ti-o pot explica eu , ca m-am edificat dupa ce am vazut vreo 20 videouri de la PBS Space . Spinul e o proprietate a particulelor ( cum e culoarea la quarks, sarcina electrica la toti fermionii etc. ), si sunt 2 categorii practic: particule ce au spin subunitar, aceste ne putand ocupa acelasi loc in spatiu ( materia de zi cu zi), si a doua categorie e cea a particulelor ce au spin nefractional, astea pot fi oricat de multe intr-un singur loc din spatiu ( de ex un LASER functioneaza fix pe principiul ca poti ingramadi oricat de multi fotoni intr-un spatiu oricat de mic).
Orientarea spin-ului si directia de ‘rotire’ sunt alte doua proprietati , astea se pot observa , ele dau efectiv directia in care zboara particula cand e lovita sau are loc radioactivitatea.
Referitor la superpozitie si prabusirea functiei de unda, iti recomand sa cauti video-uri cu “pilot wave”, www.youtube.com/watch?v=WIyTZDHuarQ
NOU
Trecand putin peste titlul cu “pe intelesul ITistilor” pentru ca am tendinta sa o iau putin personal pentru ca lucrez in IT, as vrea sa imi exprim putin parerea cu privire la acest subiect, din experienta mea, din ce am vazut eu.
Acum vreo 15 ani am facut meditatii cu copiii la matematica clasele 2-12 cautand diferite metode sa ating obiectivele cu ei si as vrea sa zic urmatorul lucru.
Din punctul meu de vedere, un copil/adultva fi interesat de subiectul pe care-l predai sau il spui, in urmatoarele situatii:
– subiectul ala face parte din aria lui de interes
– modul in care-l faci sa se simta in compania ta/cand discuta cu tine. Asta nu se invata din carti, trebuie cumva sa devina parte din tine, stilul tau natural.
In cazurile astea doua, copilul ala va lua subiectul cu interes. De fapt, in primul caz, subiectul ala n-a devenit interes din cer. Cineva a stiut sa-l impacheteze intr-un mod captivant, ca acel copil sa fie interesat sa cerceteze. De asta sunt cazuri (ca si la mine) cand ai urat matematica in 5-8 si, dintr-o data, in clasa a 9-a cand a venit un nou profesor, s-au apasat niste butoane si situatia s-a schimbat. Nu, n-a schimbat subiectul, a schimbat modul in care l-a expus si modul de interactiune cu tine, si nu are legatura cu notiunile teoretice ci mai mult cu “emotiile” trezite in tine. Un profesor ignorant, care te intreaba odata pe luna, care te face de rahat in fata clasei, care nu stie sa-ti dea mici provocari si sa te incurajeze, nu va reusi sa te faca sa fii interesat de lucrul ala. Stiu, e greu cand ai 30 de elevi in clasa.
Hai sa luam exemplu concret de pe blog. si va rog sa nu-l considerati ca pupincurism. Cineva de pe alt blog, care scrie in numai in weekenduri, ar putea sa scrie despre formula bombei atomice, impreuna cu tehnologia stealth la avioane si un curs practic despre cum sa devii bogat si nemuritor, si e posibil ca majoritatea sa nu-i citeasca articolul. Pe de alta parte, Cetin, ar putea scrie despre scara cacatului (da, exista asa ceva, www.webmd.com/digestive-disorders/poop-chart-bristol-stool-scale) si sa fie capabil te faca ca in fiecare dimineata, timp de un an, sa ti-l masori sa treci in jurnal.
NOU
Dude. Articolul nu e scris de Cetin.
NOU
N-ai inteles ce am zis, am vazut bine de la inceput cine l-a scris
NOU
Ultimul paragraf a fost o comparatie ca e important cum prezinta omul ala subiectul mai mult decat subiectul in sine. Paragraful cu “Cetin” a fost ca o comparatie intre doua subiecte, stiam ca nu l-a scris el pentru ca am inteles de la inceput ca esti pasionata de fizica si aeromodele. Asa cum pe blogul lui Zoso daca vad un titlu cu “Porumbeii din Paris”, imi dau seama de la inceput ca e scris de Fluture ca sta pe acolo.
NOU
Am înțeles ce ai spus.
Dar.
Având în vedere numărul de comentarii (și calitatea lor, cu puține excepții) pe care bloggerii ăștia de weekend le au la fiecare articol, e “posibil”, dar nu “probabil” ce zici tu acolo.
NOU
Hei, se pare ca desi exemplul meu nu s-a referit la tine, si tu ai luat-o personal asa cum am luat-o si eu cu ITistii 🙂 asa ca n-am cum sa iti reprosez asta, cand eu inceput-o. Departe de mine sa creez polemica in cazul asta, mai mult sa intaresc cu un exemplu ideea expusa.
NOU
🙂 Am schimbat titlul, btw.
Am comentat mai sus care e povestea: un ITst de la alta postare a zis ca nu poate cu fizica și matematica. A fost un fel de challenge accepted.
Dar am zis și ca dacă gasesc 10 ITsti care sa comenteze ca știau din astea, modific titlul.
I stand corrected.
NOU
Uite hai sa zic cu subiect si predicat ultimul paragraf cu nume (chiar daca nu stiu cine esti, poate chiar esti persoana in cauza, atentie, zic sa nu se interpreteze ci doar sa exprim ca vreau sa imi susin ideea indiferent cine comenteaza).
Parerea mea, cand am zis de cineva care scrie pe alt blog in weekend, cu nume si prenume ma gandeam la Fluture, si atentie, e strict parerea mea, nu zic eu ca e generala si nu zic ca e corecta, e strict in raport cu mine. Ca ai luat-o personal sau ca esti tu Fluture sau nu e irelevant (repet, sa nu se inteleaga gresit, nu zic ca esti, zic sa-mi mentin parerea indiferent cine e). Pe mine nu ma captiveaza sa fiu interesat de subiectul lui, chiar daca scrie de bombe atomice, tehnologii invizibile, teleportare sau nemurire. Pentru ca nu trezeste nimic in mine. Cel putin, nu acum. Pe de alta parte, Cetin sau Vali, daca scrie si despre scara cacatului,chiar si daca scrie ca s-a descoperit ca ITistul are cel mai moale rahat, ar putea sa ma faca sa il masor dimineata, zilnic. Asta consider ca e important ca profesor, sa stii sa apesi niste butoane. Binenteles ca un profesor nu are cum sa faca asta cu 30 de elevi, dar aici e datoria parintelui sa intre pe fir, sa fie el acel model sau sa gaseasca o persoana potrivita. si inca ceva, ca x iubeste fizica sau mate sau nu, dar iubeste altceva, e irelevant. Unii dintre noi nu facem legaturi logice.
Dar asta era tot, nu are treaba cu o categorie de oameni, are treaba cu X cum isi prezinta subiectul. Binenteles ca X nu se poate face placut de toata lumea, printr-un singur mod, si ar fi total gresit sa incerce sa se faca placut de toti, asa ca parerea mea e irelevandata daca-mi place sau nu articolul lui, daca 99% dintre cititori il roaga sa continue.
NOU
Nu sunt Fluture, dar mie îmi place cum scrie.
NOU
fluture nu ar avea permisiunea de a scrie la.mine. e prietenul lui vali, nu al meu, iar de arogante sunt satul de la ale mele, nu am nevoie de ale unui strain care mi-e si antipatic. stiu ca e greu sa crezi ca exista femei mai inteligente decat noi, dar asta e, trebuie sa te impaci cu ideea
NOU
E usor de facut legatura dintre elicoptere si fluturi…
NOU
Exact, nu amandoua zboara?
NOU
Nu vă râdeți, că a comentat cineva inclusiv că aș fi nevasta lui Zoso 🙂
NOU
Pe consecinta logica sau cum sea la matematica. Daca din 1 rezulta ca Fluture esti tu si din 2 rezulta tu esti nevasta lui Zoso atunci din astea doua rezulta ca Fluture e nevasta lui Zoso? Deja numai inteleg nimic.
NOU
Te aplaud pentru initiativa!
Pe-asta cu radioactivitatea cat de cat o stiam, ca m-a pasionat (am fost foarte pasionala la vremea mea), dar fizica in general nu mi-a placut deloc. Cel mai probabil din cauza a cum ne-a fost predata #ghinion.
NOU
Insinuezi că l-ai avut prof pe însuși Werner Johannis?
NOU
As fi vrut eu. Ne-ar fi ascultat cu atentie si ingrijorare, lasandu-ne sa trecem orice, chiar si clasa.
NOU
auzi, am citit din postura de milenial, interesant, mersi, am niste nelamuriri
daca e asa cum zici tu ca electronii sunt negativi si se atrag cu protonii pozitivi (PP), la fel ca magnetii de neodimium, de ce nu se prabusesc in nucleu ? si daca nucleul e facut din neutroni neutri (NN) si protoni pozitivi (PP) , acestia din urma de ce nu se resping intre ei si de ce nu explodeaza nucleul?
de asemenea, iti propun ca in loc de “pt prosti” sau “pt mileniali”, sa le zici “Explain like I’m 5” (ELi5)
pt episodul / postarea urmatoare, am o propunere de subiect, de ce se stramba lingura in paharul cu apa ?
mersi bafta
NOU
Exact, ai citit din postura de milenial. O intrebare pentru tine. De ce nu se prăbușește luna pe pământ? Restul cu pp și e- întra-devăr se resping până la un anumit echilibru , restul îți detaliază Maddame. Dacă-și mai bate capu’.
NOU
“de ce nu se prabusesc in nucleu”
Exact aceasi dilema il racaia si pe Bohr.
Satelitii orbiteaza pamantul datorita legilor lui Newton: potrivit primei legi satelitul vrea sa-si continue traiectoria dar potrivit legii doi, gravitatiei i-ar placea ca satelitul sa cada pe pamant. Rezultatul: satelitul nici nu o ia la sanatoasa nici nu cade ci orbiteaza (in practica final orice satelite isi pierde din orbita si se deintzegreaza la reintrarea in atmosfera).
Cand mai vezi astronauti “plutind” sa stii ca nu e din cauza lipsei gravitatiei. Chiar daca e mai slaba, gravitatia pe orbita ISS e inca suficient de puternica. Plutesc datorita legilor lui Newton: si statia spatiala si omul orbiteaza exact aceasi traiectorie.
Bohr a pornit de la ipoteza ca electronul unui atom de hidrogen orbiteaza nucleul acestuia, dar un electron in orbita ar radia lumina si in final ar cadea in nucleu.
In functie de temperatura, un corp radiaza diferit in spectru luminos: un corp mai rece radiaza rosu, un corp cu temperatura mai mare radiaza violet.
Planck se astepta ca intensitatea luminoasa sa creasca direct proportinal cu temperatura doar ca, surpriza, dupa ce atingea spectrul violet intensitatea scade desi temperatura (nivelul de energie) urca si a numit-o “catastrofa ultraviolet”.
S-a scarpina putin in cap si a concluzionat ca un corp nu poate detine orice nivel de energie ci energia asta vine in pasi discreti (in scari, nu panta).
Adica energia unui corp ce emite culoarea verde de exemplu poate fi doar multiplu de 2: 0 eV, 2 eV, 4 eV, 6 eV samd. Energia este cunatizata.
Ce legatura are cu orbitarea nucleulului de catre electron ? Pai Bohr si-a imaginat ca electronul nu poate ocupa orice orbita are chef, ci poate ocupa orbite doar la anumite distante discrete in functie de nivelul de energie in care se afla. Exact cum a descris Planck energia.
Problema e ca un electron, in functie de orbita, radiaza lumina in spectrul corespunzator nivelului de energie in care se afla, dar a ignorat complet aspectul asta si si-a imaginat ca electronul emite lumina doar cand sare de pe o orbita pe alta. In realitate electronul nu orbiteaza precum un satelit ci ia forma unor unde stationare in 3D pentru ca De Broglie si imaginat ca asa cum fotonul se manifesta cateodata ca particula, cateodata ca unda, asa si electronul si orice alta particula din univers detine aceasta dualitate. Se manifesta ca particula doar cand functia undei lui colapseaza.
In cazul electronului care orbiteaza ii observam colapsul doar in momentul in care isi schimba nivelul de energie, adica atunci cand schimba orbitele si sau frecventa undei stationare si drept urmare in acel moment se manifesta precum o particula.
Motivele pentru care electronul nu se prabuseste in nucleu se numesc legile lui Newton atunci cand se manifesta drept particula sau legile lui Maxwell atunci cand se manifesta drept unde stationare.
NOU
Particulele din nucleu sunt ținute de forța nucleară, o forța tare, dar cu raza de acțiune pe distante de nivelul Angstromilor (1A este un mm împărțit la 10 milioane).
De aia nu se resping protonii.
Cool thing: tot de aia sunt eliberate energii atat de mari la fisiunea nucleară.
@george mersi, foarte buna explicația.
Eu m-as fi oprit la principiile lui Newton și la prezentarea electronilor ca particule.
Nu m-as bagă la mecanica cuantica acum, pentru ca este nevoie de cunoștințe de baza mai vaste pentru a o înțelege (de exemplu, teoria undelor) iar cineva care nu le are o sa fie bulversat („cum plm sa fie ăla și particula și unda?”).
NOU
La intrebarea 2: Neutronul e … neutru nu are sarcina electrica. Doar sarcinile electrice de acelasi semn se resping.
NOU
Nu am spus o clipita ca sunt It-ist:), lucrez in marketing:). Multumesc pentru articol, am invatat cateva lucruri noi.
Apropo, cred cu tarie ca matematica si fizica peste nivelul elementar este inutil pentru 95% din populatie si totusi acei 5% sunt responsabili pentru progresul umanitatii:)…asa de confortabil sunt printre cei 95%…
NOU
Serios? Și eu mi-am pus toți ITștii cititori ai blogului în cap, pentru că am înțeles că erai ITst…
Oh well. #pățăști
Te-am lămurit cu radioactivitatea?
NOU
Arhi l-a botezat pe nedrep Itst. Mi-am dat seama imediat dupa ce i-am citit comentariul :))
NOU
Lamurit 🙂
NOU
frumos. cum ziceam deunazi nu-s it-st decat in timpul liber, dar chestiile astea le stiam, sunt un subiect pe care il aprofundez cu fiecare ocazie daca la timpul lui nu s-a putut. matematica, incepand cu clasa 9a a fost un lung sir de 5-uri (cu mici exceptii, ceva geometrie, ceva statistica, unde ma descurcam intre onorabil si excelent) iar fizica m-a pierdut in cateva saptamani la inceputul clasei a 6a cand a trecut de la povesti cu nori si straturi atomosferice la formulele din mecanica, electricitate si termodinamica, introducand in acelasi timp o serie aparent infinita de unitati de masura care mai de care mai ezoterice si contraintuitive. mai incolo, cand a adaugat la asta si analiza matematica, s-a dus dracului de tot.
am reusit totusi dupa facultate sa inteleg cate ceva de unul singur, chiar si un pic de analiza, si inca incerc sa completez, si de aia citesc cu placere orice tratat in domeniu, chiar daca acopera subiecte deja “stiute”.
NOU
Bancul cu care m-a cucerit domnul meu:
Einstein, Newton și Pascal se joaca de-a v-ați ascunselea. Einstein se pune.
Pascal se ascunde, dar Newton rămâne pe loc, desenează un pătrat cu latura de un metru și se așază în el.
Einstein ridica ochii:
– Pui-pui, Newton!
– Nu sunt Newton! Sunt Newton pe metru pătrat, fraiere! Sunt Pascal!
NOU
ti-as da plus, da’ nu poci….
NOU
Inginerul din mine consideră că era mai potrivit titlul “pentru IT-iști”. Nu de alta, dar mă intersectez zilnic cu bula lor și sunt mai străini de fizică (sau orice altceva) decât milenialii. 😀
NOU
itistii sunt straini de orice nu e it, in general. si le considera inutile
NOU
UFFA, n-o poti lasa nesupravegheata pe Maddame un week-end, ca transforma blogul in site de stiinta popularizata… Sah mat, umanistilor!
Acuma, ce sa spun? Ca-s habarnista total in materie ? Din cite stiu io, ca-n orice poveste sint eroii pozitivi, cei negativi si evident, neutrii, aia care chibiteaza de pe margine…
Descoperirea neutronilor astora cica fu ca nasterea cu trei moase, ca atunci cind Irene si Frederic Joliot Curie ( ea era fata altor doi Curie pe care ii cunoasteti , Marie si Pierre– ce naste din pisica, stiinta… ehm, soareci maninca) au facut experimentul de bombardare a atomilor de poloniu cu nuclee de heliu, rezultatele de pe hirtie nu prea coincideau cu ce masurau ei ca iesea de acolo. Era ca si cum ar fi aruncat o minge catre o masina si ar fi vazut masina miscindu-se foarte tare. S-au gindit la posibile explicatii, dar n-au nimerit-o.
Cind un fizician italian Ettore Majorana a auzit de experiment, a exclamat ” Ce prostanaci! Le-a trecut pe sub nas protonul neutru si nu si-au dat seama!” De unde se vede ca nici oamenii de stiinta nu sint scutiti de pacatul trufiei…. Doar ca el nu putea repeta experimentul fiind un teoric; l-a refacut insa un fizician englez, Chadwick , care a botezat si descris neutronul, luind si un premiu Nobel…
In ceea ce priveste microundele, va spun doar ca prima chestie incalzita a fost …. ciocolata din buzunarul inginerului Percy Spencer, in timp ce lucra la un radar. Cind a inteles mecanismul, a testat niste pop-corn ( care s-a imprastiat ca floricele in toata camera) si apoi un ou ( care a explodat). Nu stim ce reactie au avut nevasta acasa , respectiv femeia de serviciu de la job, probabil le-a imbunat cu faptul ca au putut incalzi ciorba fara sa mai murdareasca aragazul.
Mai multe nu mai stiu….
PS: am cautat numele exacte, pentru ca nu se facea sa povestesc ” un tip X a auzit de experimentul facut de Y si Z”, ce neutronul meu, vorbim de fizica nucleara aici, nu ne jucam cu surcele….
NOU
La ora de fizică, intra12-a, la sfârșitul semestrului ma scoate profa la tablă ca sa se decidă dacă îmi da 5-ul izbăvitor sau nu și ma întreabă cat face 2 vectorial plus 3 vectorial… la care eu, deși îmi imaginam ca răspunsul n-are cum ca fie atât de simplu, zic cu sfială: “…cinci…??!”
M-a trecut totuși.
NOU
incredibil cum, de dragul femeii, barbatii se pot da pasionati cam de orice domeniu, inclusiv radioactivitate si fizica
jokes aside: foarte tare Maddame, foarte tare. desi am avut un super prof de fizica, eu tot la pielea p^^&i m-as fi gandit cand vedeam PP.
NOU
eu stiam ca daca la PP adaugi un P, iese pilot, poliglot programator…. bine, politist, dar asta asa mai….
oricum ar fi, ceva care sa surprinda. traim in epoca surprizelor si daca cele “four women undercover” au locul lor, de ce sa nu aiba si un PP fie el cu doiz, sau cu trei de P. important este sa surprinda